JSCSF利益相反管理委員会(COI)について
- 当会では、JSCSFトリプル審査委員会事務局にて、【様式C】の確認業務を行っています。
- 当会会員以外の研究責任者、研究代表医師、研究責任医師の方は、所属機関にて【様式C】の確認を行い、【様式D】を入手した上で、JSCSFトリプル審査委員会事務局あてに、【様式A】及び【様式E】を提出してください。
- 利益相反申告者は、企業等が製造または販売しようとする医薬品・医療機器等を用いる研究を行う場合には、自身の所属機関に【様式C】を提出し、助言・指導を受け確認結果を受領することが定められています。
利益相反管理の作成方法
(「臨床研究法における臨床研究の利益相反管理について」医政研発0302第1号)
※認定臨床研究審査委員会の審査には、単施設での研究、多施設共同研究の双方
とも、利益相反管理基準【様式A】と利益相反管理計画【様式E】の提出が必要です。
平成30年3月2日医政発0302第1号)臨床研究法における臨床研究の利益相反管理について(PDF)
下記を参考に利益相反管理計画を作成してください。
JSCSF利益相反管理委員会「利益相反管理計画書の作り方(PDF)
提出用の「様式A」と「様式E」の作成は、下記エクセルをご使用ください。
001155167_利益相反管理計画書作成フォーム(ver.3.1)式・条件付き書式設定版.xls(エクセル)
- 様式A 利益相反管理基準(PDF)
- 様式B 関係企業等報告書(PDF)
- 様式C<研究責任医師用> 研究者利益相反自己申告書(PDF)
- 様式C<分担研究医師等用> 研究者利益相反自己申告書(PDF)
- 様式D<研究責任医師用> 利益相反状況確認報告書(PDF)
- 様式D<分担研究医師等用> 利益相反状況確認報告書(PDF)
- 様式E 利益相反管理計画(PDF)
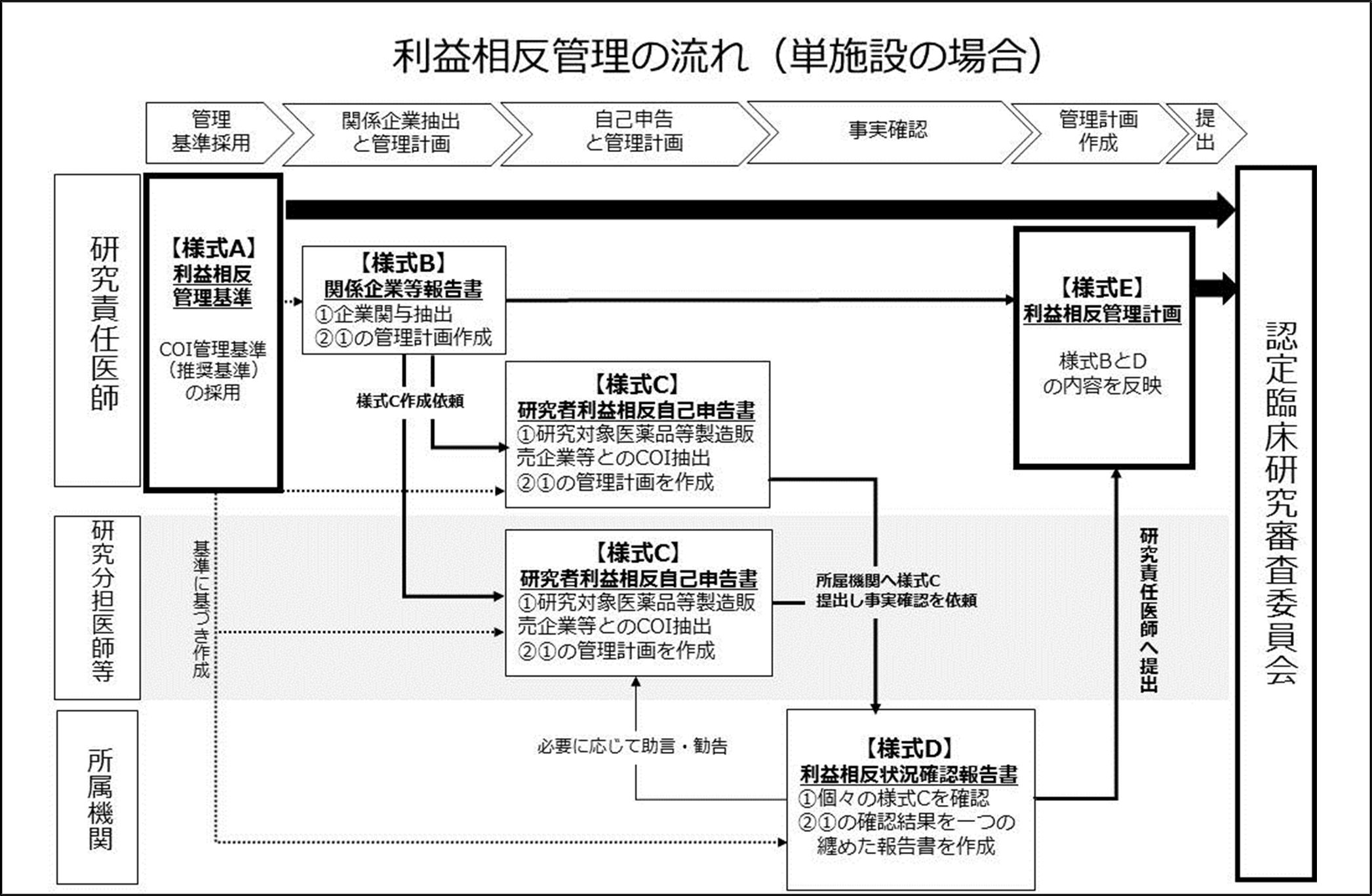
臨床研究法における標準的な利益相反管理のプロセスは以下の通りです
- 臨床研究等を行う研究責任医師は、利益相反管理基準【様式A】を作成する。
- 研究責任医師は、研究への企業の関与の内容を確定し、利益相反管理基準に基づき、当該研究への企業の関与に関する利益相反管理計画書【様式B】を作成する。
- 研究責任医師は、利益相反申告者を確定した上で、当該利益相反申告者に対して個人収入等の申告書【様式C】の作成を依頼する。
- 研究責任医師は、及び研究分担医師等の利益相反申告者は、【様式C】に個人収入等を記入し、JSCSFトリプル審査委員会事務局あてに提出する。その際、研究責任医師は【様式A】を併せて提出する。
- JSCSFトリプル審査委員会事務局は、提出された申告内容に関する事実確認を行い、必要に応じて申告者に助言・指導を行ったうえで、最終的な確認結果を研究責任医師に提供する。 【様式D】
- 研究責任医師は、【様式A】、【様式B】及び【様式D】の内容を確認し、臨床研究等に関する書類の修正等の必要な措置を講じた上で、認定臨床研究審査委員会に対して利益相反管理計画書【様式E】を提出する。
単施設での研究における利益相反管理について
多施設共同研究における利益相反管理について
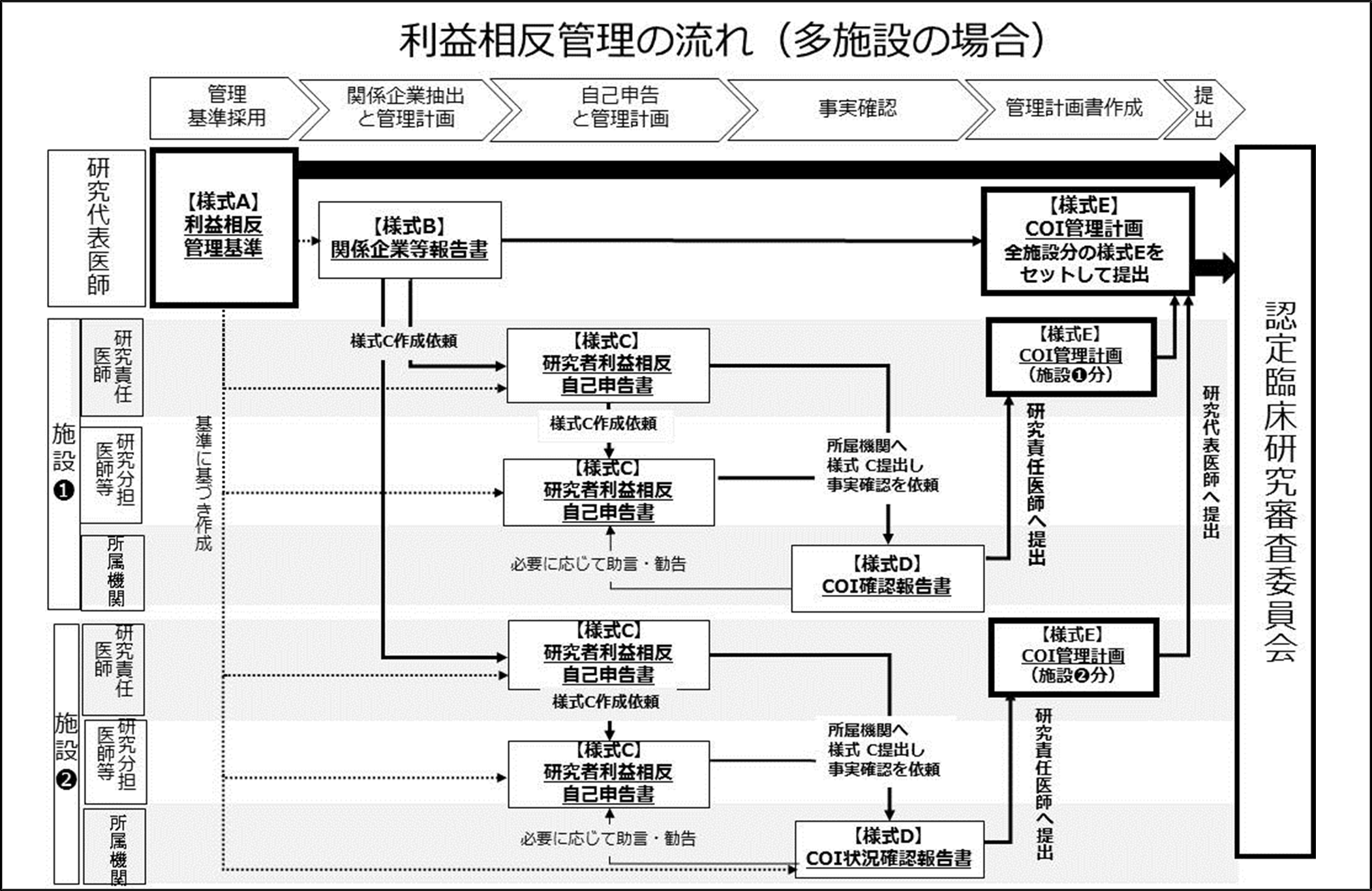
臨床研究法における標準的な利益相反管理のプロセスは上記の図の流れとなります。ただし、単施設と多施設の研究では多少異なるプロセスとなります(図を参照)。
具体的には、多施設共同研究の場合、利益相反管理基準の採用と企業関与の内容については研究代表医師が一括して担当するが、その後の自己申告については各施設の研究責任医師を通じて研究分担医師等に依頼が行われ、施設ごとに利益相反管理計画書が作成されることになります。
その後、研究代表医師は作成された全施設分の利益相反管理計画書を取りまとめて認定臨床研究審査委員会に提出し、審査を受けます。
利益相反に関する規定(臨床研究法より)
利益相反管理に関しては、臨床研究法のほか、省令、通知、ガイダンス等で定められています。
















